研究標的は”受容体”
細胞の表面、内部、核内など、様々なところにたくさんの「受容体」があります。そして、特異的に結合するホルモンなどの「リガンド」が、それらの受容体にを介した情報伝達を制御しています。私たちは、特に細胞核内で遺伝子転写を制御する全ての核内受容体(ヒト48種)、痛みや鎮痛に関わる神経ペプチドとその受容体について、受容体/リガンドの分子認識および活性化機構解明など受容体化学の研究を行っています。
環境科学:環境化学物質と受容体の構造機能相関
私たちは文明の発展により便利な生活を享受しています。その結果として、環境中には様々な化学物質が存在しています。そして、このような化学物質が私たちに影響をおよぼすとき、多くの場合では、まず初めに化学物質と受容体の結合がおこります。私たちは細胞の核のなかに存在する核内受容体について、結合試験や転写活性測定により、化学物質と受容体の構造機能相関解析をおこなっています。
核内受容体はヒトでは48種類存在しています。そのなかから、ビスフェノールAが非常に強く結合するエストロゲン関連受容体γ型を発見しした。さらに、ユニークなエストロゲン受容体応答特性を示すハロゲン含有の新世代ビスフェノール(ビスフェノールAF)を見いだすなど、社会的に注目される画期的な研究を行っています。最近では、これらの成果から、転写制御機構の分子メカニズム解明にも繋がる重要な研究へと発展・展開しています。
〜ビスフェノールAF結合の発見物語〜
「あなたは無駄にたくさん実験している。」そう言われたが、あきらめきれなかった。内分泌撹乱物質、いわゆる環境ホルモン問題については、大規模に調査が行われており、エストロゲン受容体とビスフェノールAの結合は天然ホルモンの1,000〜10,000倍も弱いことが報告されていた。さらに、当時でも既に1,000化合物以上もスクリーニング(多くを解析して目的物を選別すること)が終了していた。そして、内分泌撹乱物質と呼ばれる化合物のエストロゲン受容体に対する結合能は、概して弱いことが報告されていた。そのため、研究室のなかでは、ビスフェノールAが結合する「エストロゲン受容体以外の」核内受容体の存在へと注目が移っていた。そこで、約200種を超えるビスフェノールAの誘導体と様々な核内受容体との結合試験が、連日行われていた。ロボットになったような気分だった。こうしたなかでは、誰もが、ビスフェノール類はエストロゲン受容体にはほとんど結合しないと言える程、弱くしか結合しない、と認識していた。
しかし、ハロゲン含有フェニルアラニンを化学合成し、ペプチドに組み込んで生物活性を測定した経験のある私には、フェノール骨格を2つも持つビスフェノールAの誘導体は、受容体結合に好まれる骨格(プリビレッジド ストラクチャー)であるように思えてならなかった。だからこそ、誰も手をつけなかったエストロゲン受容体と約200種を超えるビスフェノールAの誘導体の結合試験を黙々と続けた。もちろん、ほとんどの化合物はほとんど結合しなかった。しかしある日、人気が無く薄暗いRI(放射性同位体)センターで、放射カウントの結果が次々と書き出されていくのを早く終わらないかと眺めていた時、その数値が他の化合物と比較して一段と低くなっている欄があるのに気が付いた。
こうして見つかったのが、ビスフェノールAFを初めとする、ハロゲン含有の新世代ビスフェノールであった。一見無駄に思えた実験を黙認なされた当時の教授には感謝にたえない。実験科学者なら誰しも考えることであろう。「実験の結果はやってみるまでわからない」のである。
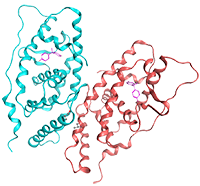
ビスフェノールAと核内受容体ERRγの結合体のX線結晶構造解析。脳神経系や生殖系に悪影響をおよぼすと報告されている内分泌撹乱物質・ビスフェノールAに、非常に強く結合する核内受容体ERRγを発見し、その結合構造を世界で初めて解明しました。
受容体化学:核内受容体および神経ペプチド受容体の構造機能解析
核内受容体は細胞核内で転写を精密に制御する転写因子です。そして、女性ホルモン・エストロゲンの受容体も核内受容体です。そして意外なことに、エストロゲン受容体α型とβ型の二種類が、全く別の遺伝子として存在しています。なぜ、二種類の受容体が存在するのか、正確な理由ははっきりしません。この謎に迫る研究を展開しています。
さらに、脳内の鎮痛ペプチド、痛覚神経刺激ペプチド、血液凝固系のトロンビン受容体内蔵リガンドペプチドなどのペプチドホルモンについて研究しています。ペプチドが受容体のどこに、どのように結合し、どのように受容体が起動するのかを分子レベルで解き明かす研究に取り組んでいます。特異構造のアミノ酸の設計・合成、ペプチド合成、遺伝子操作による改変受容体の作製、受容体結合試験、生理活性アッセイ、ペプチドの立体構造解析(NMR, CD)、コンピュータによる分子モデリング、コンホメーション変化の解析などを実施しています。最近では、受容体の新たな化学修飾部位について研究を展開しています。
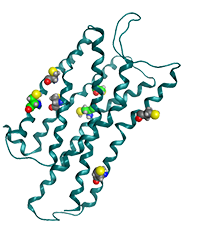
疼痛ペプチド、ノシセプチン受容体の構造。ノシセプチン受容体は細胞膜表面に存在するGタンパク質結合型受容体である。この図は受容体の膜貫通領域にある7つのシステイン残基をCPKモデルで表示したもの(PDB ID:4EA3)。
脳神経化学:化学物質暴露による行動への影響解析
特にビスフェノールA食餌による生体への影響を、マウスなど実験動物の活動リズムを指標に解析しています。活動リズムに影響をおよぼす分子機構を解明するため、概日リズムに関わる時計遺伝子、時計タンパク質、情報伝達神経ペプチドの遺伝子解析などを実施しています。